|
译者简介

张斌
浙医二院急诊医学科 火凤凰翻译组成员 2016年11月加入FPTG
背景急性疾病常以心血管稳态失调为特征,其潜在机制可能包括改变血容量(实际或有效血容量)、心脏功能(舒张和/或收缩功能)或血管(大和/或微血管)的多种因素。在实践中,各种药物具有不同的作用机制,并且在风险平衡方面有所不同。本综述提供了当前有关血管加压药和正性肌力药物知识的总结,以指导重症监护医师在处理休克患者时的实践。
药理学基础儿茶酚胺类
血管活性药分为拟交感神经药、加压素类似物和血管紧张素II。儿茶酚胺类进一步细分为间接、混合作用和直接作用三类。只有直接作用类在休克中起作用。直接作用类通过其选择性活性(如多巴酚丁胺、苯肾上腺素)或在α1、α2、β1、β2和β3受体上的非选择性活性(例如肾上腺素、去甲肾上腺素)进一步划定。儿茶酚胺通常与休克状态下的临床改善有关。儿茶酚胺类药物通过刺激α或β受体起作用,在平滑肌上施加兴奋作用并导致皮肤、肾和肺中的血管收缩或血管扩张效应。肾上腺素或去甲肾上腺素的静脉内(IV)给药导致血压随剂量增加而升高。血压升高是由于血管收缩和β受体刺激引起的。刺激β受体直接增加了心脏收缩力和心率。 尽管受体反应经典地呈现为线性,但所有药理学反应随着剂量的增加应均遵循S型曲线,随后出现平台效应。多巴胺受体至少包括广泛分布于中枢神经系统、肺和全身血管、心脏组织和肾脏中的5种亚型。对受体的影响为儿茶酚胺休克治疗提供了药理学基础。临床医生还应该意识到它们对肝脏和平滑肌糖原分解、脂肪组织释放脂肪酸、调节胰岛素释放和摄取、免疫调节和中枢神经系统中的精神运动活性的影响。
加压素和类似物
加压素是由低血压和高钠血症引起垂体后叶释放的一种强效的九肽血管加压素激素。加压素刺激受体-V1a(血管收缩)、V1b(ACTH释放)、V2(抗利尿作用)、催产素(血管扩张剂)和嘌呤能受体(与脓毒性休克有限相关)。血管加压素反而诱导一氧化氮(NO)合成。NO可能会限制加压素的血管收缩,同时保持肾脏灌注。但是,它也可能促进血管加压素/NO诱导的心脏抑制。值得注意的是,V1a受体激活血管平滑肌诱导的血管收缩不依赖于儿茶酚胺,可以解释为什么加压素在感染性休克中可以与去甲肾上腺素联合应用。输注血管加压素在感染性休克中的主要原理已经明确。脓毒性休克早期加压素缺乏是由于加压素储存消耗和来自下丘脑- 垂体轴的合成和释放不足。低剂量加压素输注0.01-0.04单位/分钟,升高血压并降低去甲肾上腺素的需要量。在脓毒性休克恢复过程中,加压素缺乏及其抗利尿作用仅在后期才变得明显,约60%的患者在脓毒性休克恢复5天后血管加压素对渗透刺激的反应不足。高选择性V1a激动剂在脓毒性休克中比加压素有更好的作用,因为其仅对V1a受体起作用。除了极少的V2抗利尿作用外, von Willebrand因子释放(V2介导)报道较少或没有,并且与加压素相比,在动物模型中有一些证据表明V1a激动剂有较少的血管渗漏。高选择性V1a激动剂selepressin 比加压素和对照组能更多的降低肺水肿和液体平衡,并降低血浆总蛋白浓度和胶体渗透压。
钙增敏剂
钙增敏剂通过使心肌对现有钙敏感增加而不是增加细胞内钙浓度而产生正性肌力效应。这具有产生心肌收缩(内向性)增加的优点,而不向其他正性肌力药一样增加氧需求。此外,随着舒张期钙水平降低,钙增敏剂不会像其他正性肌力药一样损害心肌松弛。
左西孟旦是唯一临床使用中的钙增敏剂。ATP敏感的钾通道在血管平滑肌中的开放导致血管舒张和通过心肌细胞线粒体中的作用,据报道其对心肌局部缺血发生具有心脏保护作用。在更高的剂量下,它也显示抑制磷酸二酯酶III的作用。虽然左西孟旦的母体药物半衰期短,约1小时,但其活性代谢产物OR1896的半衰期很长,因此24小时输注左西孟旦可以产生约1周的血液动力学效应。
选择性β-1受体拮抗剂
尽管交感神经刺激对脓毒症是一种合适的生理反应,但有证据表明,如果过量可能成为病理性反应。高水平的循环儿茶酚胺和心动过速与脓毒性休克的病死率增加有关。虽然心肌功能障碍在脓毒症中很常见,但短效β1受体拮抗剂可能通过减慢心率,改善舒张功能和冠状动脉灌注而有益心血管功能。艾司洛尔是一种心脏选择性β1受体拮抗剂,起效迅速,作用时间很短。 兰地洛尔是一种超短效β受体阻滞剂,对β1受体的选择性比艾司洛尔高8倍。
其它
历史上,血管紧张素被认为是一种有效的血管收缩剂。血管紧张素主要通过刺激NADH / NADPH膜结合氧化酶随后血管平滑肌产氧来增加血压。最近,合成的人血管紧张素II显示与去甲肾上腺素协同作用以升高血管舒张性休克患者的血压。亚甲基蓝和非选择性NO合酶抑制剂通过调节内皮血管舒张诱导血管收缩,而III型磷酸二酯酶抑制剂通过调节循环AMP代谢发挥正性肌力效应和血管舒张作用。
对心脏的影响儿茶酚胺类
血管活性药物用于休克,目的是对抗血管麻痹、心肌抑制或两者皆有。血管活性药物的潜在益处应与对心输出量(CO)、心肌耗氧量、心肌灌注和心律的可能负面影响相平衡。去甲肾上腺素对心脏功能和CO的影响是不一致的和时间依赖性的,这可能与基础心血管基础状态、心室 - 动脉交互和潜在的心肌抑制伴后负荷增加有关。通常,去甲肾上腺素的直接正性变时效应受到血压增加后迷走神经反射活动的平衡。去甲肾上腺素还通过刺激冠状血管β2受体部分地增加了每搏输出量和冠状动脉血流量。去甲肾上腺素对心脏功能的这些潜在的积极作用通常是短暂的。肾上腺素是比去甲肾上腺素更强大的心脏功能兴奋剂,即具有更多的β-肾上腺素能作用。肾上腺素加速心率、改善心脏传导、刺激心脏舒张速度并增强收缩效率,随后CO的增加以心脏功和氧耗急剧增加为代价。肾上腺素不会由于缩短收缩期而增加舒张末期、减少舒张期心肌的阻力、加速收缩后舒张或增加充盈压而缩短舒张期。肾上腺素可能与去甲肾上腺素相比具有更高的心动过速和心律失常风险。多巴胺通过多种受体起作用;在2-15μg/ kg / min的输注速率下,该药以心动过速为代价刺激β1-受体增加心肌收缩力,并增加心律失常的风险。休克中刺激心脏多巴胺受体的临床效果尚不清楚。去氧肾上腺素是一种纯α激动剂,可增加后负荷并降低心率和CO。
加压素和类似物
加压素及其类似物可能通过加压素V1a受体介导的β-肾上腺素能受体敏感性降低而降低心脏收缩力。同样,血管紧张素可能会通过增加后负荷来损害CO。
正性肌力药
正性肌力药用于心肌抑制患者,通过增强心肌肌收缩力来改善CO。虽然多巴酚丁胺可能起初会降低血管张力,但MAP通常随着CO增加而改善,除了在全身血管阻力低的情况下。磷酸二酯酶III抑制剂也增加心肌收缩力(可能与多巴酚丁胺有协同作用),但通常与低血压和心律失常有关。尽管这些药物对右心室后负荷的影响可能对右室衰竭有益,但对保持冠状动脉灌注应非常小心。。左西孟旦增加收缩性和CO,很少引起心动过速,并且不增加心肌耗氧量,但MAP常显著下降(尤其是负荷剂量)。在心源性休克中,与多巴酚丁胺相比,左西孟旦可能导致更高的CO和更低的心脏前负荷。
选择性β-1受体拮抗剂
短效选择性β1受体拮抗剂在实验性脓毒症和心力衰竭中增加收缩功能和左心室舒张末期容积,降低心肌耗氧量,并恢复心脏变异性。这些药物显示严重脓毒性休克和心动过速患者的心搏量和CO显著改善。
对体循环和肺循环的影响去甲肾上腺素和肾上腺素对于全身血压和全身血管阻力的影响是等效的。低剂量肾上腺素可能通过激活血管β2肾上腺素能受体降低全身血压,这是一种与去甲肾上腺素不同的效应。去甲肾上腺素和肾上腺素同样增加了肺动脉压力和肺血管阻力,对肺毛细血管楔压几乎没有影响。去甲肾上腺素也可能通过增加静脉回流来减少对前负荷的依赖。高剂量多巴胺(10-20μg/kg / min)刺激α-肾上腺素能受体并增加全身血管阻力。 然而,临床上它通过增加CO增加MAP,几乎没有外周血管收缩。多巴酚丁胺降低全身性和肺血管阻力,而由于CO增加,全身血压几乎没有变化。加压素常在去甲肾上腺素效果不佳时联合使用并降低去甲肾上腺素的需要量。这种药物会增加后负荷而无肺血管收缩。加压素可能对右心功能有益。然而,有关于其作为心脏术后主要药物引起血管痉挛综合征包括心律失常和心肌梗死的报道。在脓毒性休克中,selepressin降低去甲肾上腺素的需求并限制液体正平衡。该药物已在IIb/III期试验中进行了研究,现已完成868例患者的招募。在伴有血管舒张性休克的成年人中,一种新的合成人血管紧张素II显著增加全身血管阻力而不改变CO,随后血压升高。在脓毒性休克中,左西孟旦的输注与全身性血管阻力的显著降低有关,需要增加去甲肾上腺素的剂量。有趣的是,左西孟旦可降低肺血管阻力,并可在肺动脉压力高时改善右心室功能。
对局部血流的影响一般而言,β-肾上腺素能药物、磷酸二酯酶III抑制剂和左西孟旦增加内脏灌注,而α-肾上腺素能药物和加压素具有更多的可变效应。几项研究表明多巴胺通常会增加内脏灌注,但个体差异性较大。在低剂量(5μg/kg/min)下观察到此效果,且剂量递增不会进一步影响内脏灌注。
血管活性药物可以通过恢复器官灌注压来改善内脏灌注。高于自动调节范围的压力可以是中性或有害的。需要考虑两个因素:药物的性质和剂量可能会影响反应。在低剂量时,肾上腺素能药物具有相似和中性的效果; 而高剂量会损害内脏灌注和新陈代谢。同样,加压素低剂量时对内脏循环有轻度影响,但在高剂量时内脏循环明显受损。
只有在低CO时,正性肌力药才能改善肾灌注。血管活性药物在纠正低血压时改善肾灌注。加压素可能通过对小动脉的优先效应对肾小球滤过压产生更大的影响,这解释了与去甲肾上腺素相比,在相同血压下使用加压素会获得更多的尿量和更高的肌酸酐清除率。
对微循环的影响当平均动脉压降至60-65mmHg的自动调节阈值以下时,器官灌注变成压力依赖性。在这种情况下,使用血管加压药增加MAP可能改善严重低血压性脓毒性休克患者的微循环血流。另一方面,在自动调节阈值以上,血管加压药引起的血管过度收缩也可能是有害的。在脓毒性休克中,MAP达到65mmHg以上随着去甲肾上腺素剂量增加,根据基础微循环状态、时间或其他因素,个体反应有相当大的变化。去氧肾上腺素对休克患者的微脉管系统灌注有不利影响。加压素(或类似物)对微循环有不同的影响。最近的研究表明加压素(或类似物)具有与去甲肾上腺素相当的效果。在顽固性低血压的临床实践中,用去甲肾上腺素增加MAP可改善微循环灌注。尽管如此,最佳微循环灌注的最佳MAP和血管活性药物剂量是相当可变的,应该针对个体进行调整,并且在可能的情况下进行监测。多巴酚丁胺对微循环的反应具有较高的个体差异性,导致试验之间不同的结果。,因为实验模型中的有益作用和临床数据的稀缺,左西孟旦和磷酸二酯酶III抑制剂的作用仍然不确定。
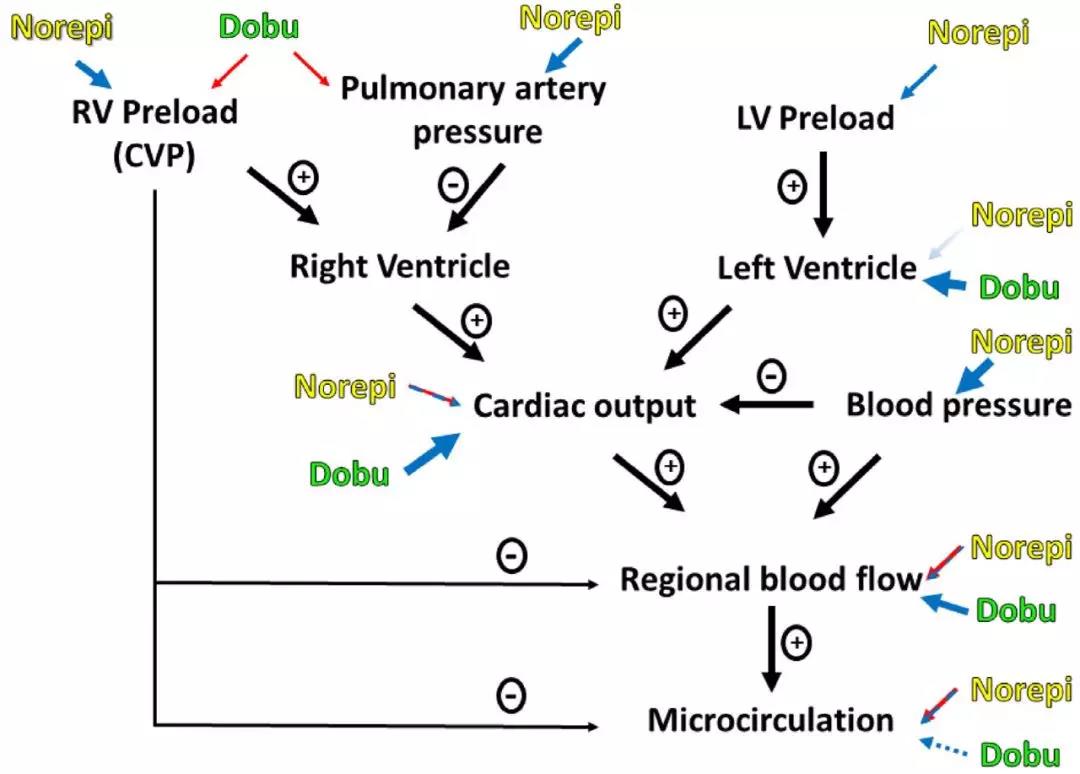
图1. 去甲肾上腺素(Norepi)和多巴酚丁胺(Doobu)对心输出量及局部和微血管灌注的影响。用彩色箭头表示去甲肾上腺素和多巴酚丁胺的作用:蓝色箭头表示相应血液动力学变量的增加,红色箭头表示相应血液动力学变量的减少,双色红色/蓝色箭头表示变量效应(可以是正值或负值, 取决于时间,患者状况或血压水平)。普通箭头表示在大多数患者中观察到的效应,虚线箭头表示在一些但不是所有患者中观察到的效应(但没有有害的效应)。箭头的粗细代表效应的大小。渐逝箭头表示随时间推移而减少的效应。
对代谢的影响表1总结了血管活性药物的非心血管效应。刺激α-肾上腺素能受体导致胰腺B细胞的胰岛素释放减少,垂体功能降低,并且抑制脂肪组织中的脂肪分解。刺激肝脏β-肾上腺素能受体通过增加环磷酸腺苷的形成,增加葡萄糖生成和糖原分解。在骨骼肌中,由于缺乏葡萄糖-6-磷酸酶,β-肾上腺素能刺激激活糖原分解和乳酸产生。实际上,与去甲肾上腺素相比,肾上腺素输注与短暂的非临床相关的血清乳酸水平增加和动脉pH降低相关。没有证据表明加压素或其类似物、人工合成血管紧张素II和左西孟旦在危重病人中使用时有任何代谢作用。
表1. 血管活性药物的非心血管效应总结
| 代谢效应 | · ↓胰腺释放胰岛素(刺激α-肾上腺素能受体)
· 抑制脂肪组织中的脂肪分解(刺激α-肾上腺素能受体)
· ↑肝葡萄糖生成和糖原分解(β肾上腺素能受体的刺激)
· ↑骨骼肌糖原分解和乳酸产生(刺激β-肾上腺素能受体) | | 内分泌效应 | · ↓垂体前叶激素血清浓度:催乳素,TRH,hGW和LH(多巴胺)
· ↓TSH分泌(多巴胺)
· 下丘脑 - 垂体轴的稳定作用(血管加压素) | | 免疫学效应 | · 短暂的T细胞高反应性(多巴胺)
· ↓内毒素介导的促炎细胞因子的释放(去甲肾上腺素和肾上腺素)
· 上调抗炎细胞因子(去甲肾上腺素和肾上腺素)
· 潜在的刺激细菌生长(去甲肾上腺素和肾上腺素)
· ↓循环促炎性细胞因子的水平(左西孟旦,加压素)
· ↓IL-6水平和亚硝酸盐/硝酸盐水平(Selepressin) |
TRH促甲状腺激素释放激素,hGW人生长激素,LH促黄体激素,TSH促甲状腺激素,IL-6白细胞介素6
对内分泌的影响多巴胺通过垂体前叶中的D 2受体和下丘脑正中隆起降低所有前垂体激素(催乳素,促甲状腺激素释放激素,生长激素和黄体生成素)的血清浓度。多巴胺还可以通过抑制促甲状腺激素分泌和降低甲状腺素和三碘甲状腺素水平导致或加重低T3综合征。此外,多巴胺可以抑制血清脱氢表雄酮硫酸酯,由低水平的催乳素或甲状腺激素介导的效应。此外,多巴胺使生长激素脉冲式分泌减弱并降低胰岛素样生长因子-1的浓度,这与外周组织和骨合成代谢有关。加压素通过V1b受体调节下丘脑 - 垂体轴的ACTH释放,并通过V1a受体通过肾上腺皮质释放皮质醇。
对免疫的影响危重患者的免疫功能障碍从过度炎症反应至免疫麻痹而不同。脓毒症的特征可能是缺陷型抗原呈递、T和B细胞介导的免疫以及天然杀伤细胞介导的免疫缺陷、T-regs相对增加、PD-1活化、免疫球蛋白水平降低、嗜中性粒细胞定量和定性改变、高细胞血症、补体消耗和中性粒细胞细胞外扑捉的细菌杀死/持续存在缺陷。儿茶酚胺可能加重脓毒症相关免疫麻痹。多巴胺能降低血清催乳素水平,引发短暂T细胞低反应性,并可降低淋巴细胞计数,但血清脱氢表雄酮也可能起作用。另外,多巴胺还可以通过促细胞分裂剂抑制淋巴细胞的转化。肾上腺素和去甲肾上腺素可下调内毒素诱导的免疫细胞释放促炎症细胞因子和上调抗炎细胞因子(例如IL-10)。它们还可以通过邻苯二酚部分从乳铁蛋白和转铁蛋白中除去铁并随后通过细菌获得来刺激细菌生长。相比之下,选择性β1阻滞可能降低循环和组织炎性细胞因子的浓度,可能抑制细菌生长,并可改善纤溶。在失代偿性心力衰竭患者中,左西孟旦可显著降低促炎性细胞因子(IL-6,TNFα和TNFα/ IL-10比率)和可溶性凋亡介质(可溶性Fas和Fas配体)的循环水平,部分是由于血流动力学的改善。血管加压素相比去甲肾上腺素能更好降低血浆细胞因子,特别是休克较轻的患者,血管加压素具有其他复杂的免疫效应。Selepressin诱导的IL-6和亚硝酸盐/硝酸盐水平降低可能会减轻与血管舒张性休克相关的血管通透性。
对生存的影响血管活性药物在休克中改善血液动力学参数的程度受到个体药物的选择,剂量和时间和/或药物联合的影响。不幸的是,缺乏最常用药物明确的生存益处。高质量随机试验的Cochrane评价发现血管活性药物的选择与生存益处无关。因此,对血管活性药物选择的推荐应基于对器官功能障碍的效应和药物的安全问题,而不是生存益处。
脓毒性休克去甲肾上腺素是推荐的一线血管活性药物。肾上腺素、苯肾上腺素和加压素通常被认为是二线药物,多巴胺仅用于心动过缓患者。去甲肾上腺素和肾上腺素达到类似的休克逆转,并没有随机试验显示使用一种药剂的生存优势超过另一种。同样,联合去甲肾上腺素和多巴酚丁胺的28天生存率与单独使用肾上腺素相似。值得注意的是,VANISH试验比较了早期血管加压素和去甲肾上腺素的肾衰竭天数和病死率,两者没有差异。在血管升压药依赖性休克的大型双盲试验中,去甲肾上腺素中联用低剂量的加压素并不能改善生存率,但对于不严重的患者(去甲肾上腺素<15μg/min)不排除潜在的益处。在该试验中,加压素和氢化可的松对生存有协同作用。但是,这些有益效果在VANISH试验中未得到证实。同样,没有大规模的以病死率作为主要结局的试验比较去甲肾上腺素和苯肾上腺素或其他V1a激动剂如特利加压素或血清素。最后,一项比较去甲肾上腺素与多巴胺治疗休克的大型盲法试验(SOAP II)报道,多巴胺作为一线治疗的心律失常事件增加,但总体生存率(主要终点)或预先定义的脓毒性休克亚组的生存率无差异。此外,26家美国医院在6个月内出现去甲肾上腺素短缺导致病死率增加(在此期间去甲肾上腺素大部分被苯肾上腺素和多巴胺替代)。
多巴酚丁胺和左西孟旦等正性肌力药物也被认为是用于治疗顽固性休克的二线药物。对33项脓毒性休克血管活性药物随机试验的网络荟萃分析报道左西孟旦、多巴酚丁胺、肾上腺素、加压素和去甲肾上腺素加多巴酚丁胺均与生存率显著相关,左西孟旦和多巴酚丁胺疗效最佳。相反,在血管升压药依赖性休克中进行的多中心、双盲试验报道左西孟旦(与安慰剂相比)心律失常和呼吸机脱机困难增加,生存无差异。在该试验中,随机分组根据存在或不存在左心室功能障碍的进行分层。一项小型(n=77)单中心试验报告在选择的脓毒性休克患者中使用艾司洛尔降低了病死率。有趣的是,具有正性变时效应的药物可能与不具有正性变时效应或具有负变时效应的药物相比具有更高的死亡风险(图2)。
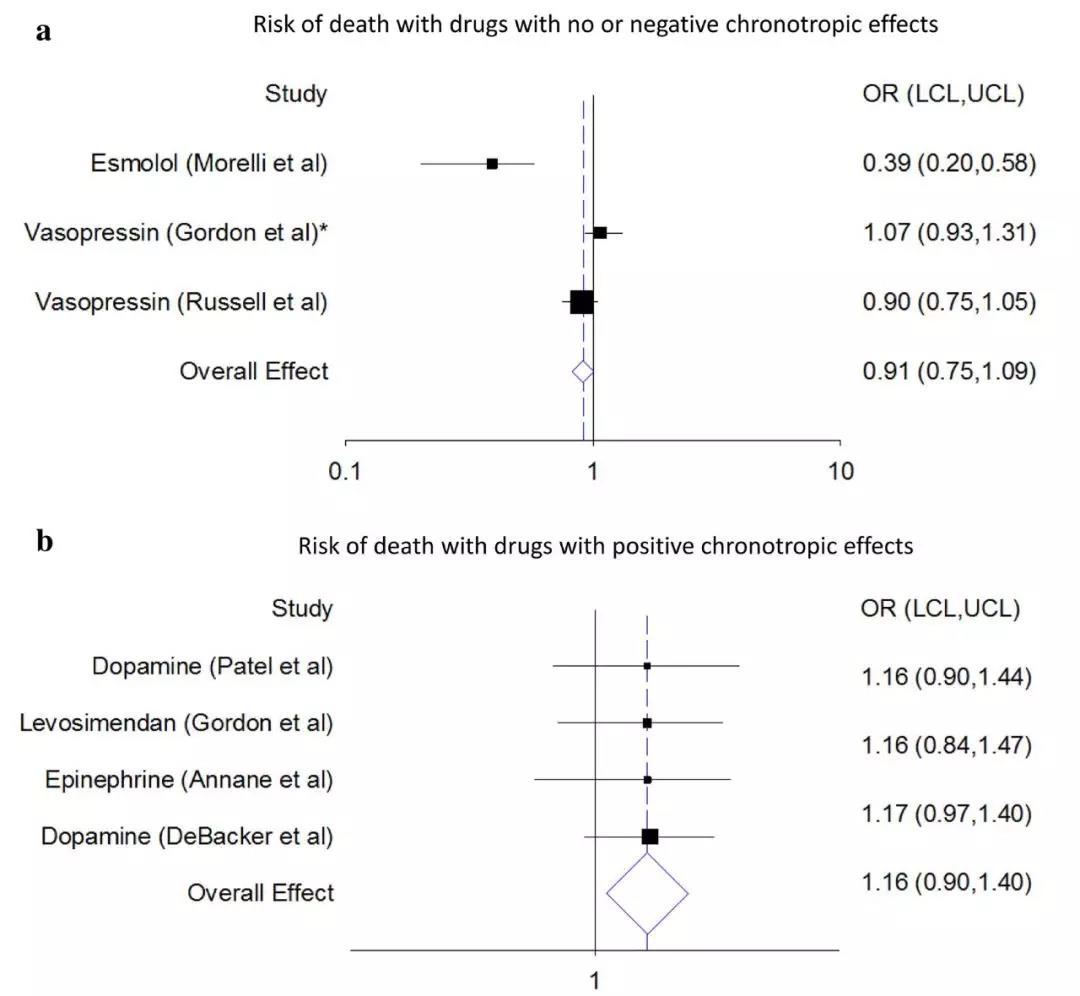
图2. 脓毒性休克试验中药物的变时效应和病死率之间的潜在关系。 根据没有正性变时效应或负性变时效应(a)对比正性变时效应(b)相关的药物进行分层的脓毒症试验的Forrest图。 降低或保持心率不变的药物与病死率优势比低于1的95%置信区间(包括无效果或伤害)相关(a)。 导致心动过速的药物与病死率优势比超过1的95%置信区间相关,包括无效或安全(b)。
其他类型的休克在其他形式的由过敏反应或胰腺炎引起的分布性休克中,缺乏高质量证据和随机试验来检测血管活性药物对生存的影响。最近有报道称在多中心、双盲的血管舒张性休克实验中,合成人血管紧张素II可以改善由于各种原因导致以及对传统血管活性药物无效的的血管舒张性休克的MAP。但是,建议在低心输出量休克时慎用。还指出有改善生存率的非显著趋势(次要结果)。加压素(高达0.06U /分钟)和早期给予亚甲蓝也可以改善心脏手术后血管痉挛性休克的生存。
尽管在心源性休克中广泛使用血管活性药物,但缺乏指导选择的证据。SOAP II实验报告,在心源性休克患者亚组中与去甲肾上腺素相比,多巴胺的死亡风险具有统计学显著性。尽管该实验是迄今为止支持去甲肾上腺素治疗心源性休克的最大规模的随机试验,但也有人提出了关于其结果是否具有广泛有效性的问题。去甲肾上腺素与较少的心律失常相关,基于目前的数据可能是大多数心源性休克患者首选的血管活性药物。其他因素如心源性休克的原因或表现类型也可能影响血管活性药物的选择。心力衰竭患者常规使用正性肌力药与病死率增加有关。然而,在心源性休克患者中,正性肌力药物被用于血流动力学支持,并且在优化重要器官的灌注方面具有重要作用。多巴酚丁胺和米力农均可改善心肌收缩力而增加心输出量。这两种药物均伴有心律失常和全身性低血压。尽管米力农具有较长的半衰期且与更严重的低血压相关,但比较这两种药物的研究表明了两者临床结局相同。
失血性休克是创伤中最常见的休克类型。治疗目标是恢复血容量和控制出血。血管活性药物可以在存在威胁生命的低血压的情况下暂时使用。血管活性药物对创伤结局的影响知之甚少。动物研究和一个小的临床试验表明,加压素联合快速控制出血可以改善血压,而不会导致失血增加,从而改善结局。然而,观察性研究表明,血管活性药物的使用通常与创伤患者的病死率增加独立相关。
实际应用在日常工作中,医生应尽可能考虑个体化使用血管活性药物,同时考虑到患者的合并症和生理特征、休克的病因学、当地的环境和他们对市场上各种血管活性药物的使用经验。
血管活性药物的选择经过充分的复苏和评估后,确定选择何种血管活性药物取决于发生低血压的病因和患者的病理生理学(图3)。在低血容量、心源性和梗阻性休克中,低血压由CO减少引起。在这些类型的休克中,局部灌注可能与全身灌注相关。然而,分布性休克(脓毒症、胰腺炎等)较为复杂,伴有血管麻痹、分流、氧摄取减少以及低、正常或高CO。
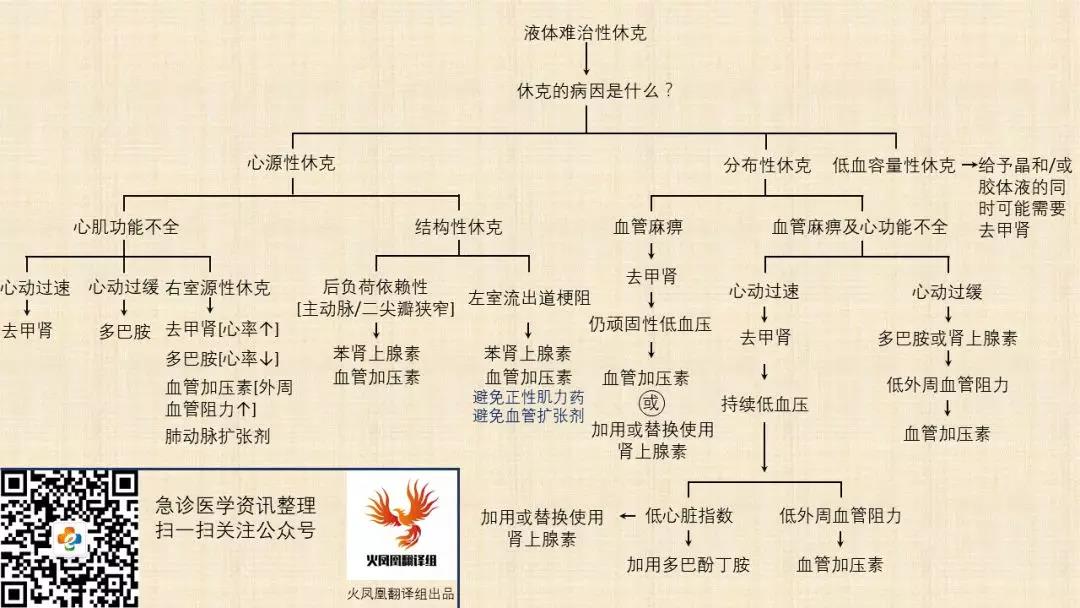
图3. 根据循环衰竭的病因使用血管活性药物的决策树
在液体复苏无效的低血压中,需要使用血管活性药物并可以在液体复苏期间开始,并且随后以可耐受的方式撤除。如果可能,超声可以帮助确定休克病因和/或协助继续治疗。
在心源性休克中,CO的降低通常是由于心肌功能差。个体化MAP目标是必需的,因为低灌注风险应与CO、心肌耗氧量、缺血和心律失常的潜在负面影响相平衡。在急性心力衰竭(不包括心肌梗塞血运重建前)中,指南推荐正性肌力药(多巴酚丁胺,多巴胺,磷酸二酯酶III抑制剂)作为一线药物。在伴心动过速的持续性低血压性心源性休克中,建议使用去甲肾上腺素;对于心动过缓患者,可考虑使用多巴胺。在特定的依赖后负荷状态(主动脉瓣狭窄,二尖瓣狭窄)的患者中,建议使用苯肾上腺素与加压素。
在分布性休克中,适当的液体复苏后,推荐使用去甲肾上腺素作为最初的血管活性药物。如果低血压持续存在,应考虑使用加压素(最高0.03 UI / min)以减少去甲肾上腺素的用量,并可能需要肾脏替代治疗。
心肌抑制在脓毒性休克中很常见。持续性低血压伴有心肌抑制和灌注减少的患者可能受益于在去甲肾上腺素的基础上联用多巴酚丁胺或使用肾上腺素作为单一药物的正性肌力治疗。多巴胺仅推荐用于伴有心动过缓或心动过速风险低的低血压患者。去氧肾上腺素应留作抢救治疗。
围绕左西孟旦合理使用存在不确定性,应在将其纳入指南的标准治疗之前予以廓清。同样,在多中心试验中进行评估前,我们无法推荐使用β1受体拮抗剂。
治疗目标血液动力学支持应优化对重要器官的灌注,确保细胞充足的氧输送。平均动脉压反映组织灌注。基于其自身调节血流的能力,特定器官对低血压具有不同耐受性。然而,存在MAP阈值,在阈值以下组织灌注线性地依赖于血压。目前的指南推荐滴定血管升压药以在脓毒性休克的早期复苏中维持65mmHg的MAP。然而,休克患者的最佳MAP目标仍然是一个争论点。针对较高MAPs(85 vs 65 mm Hg)的小型研究显示,85mmHg的MAP与较高的心脏指数相关,但其他测量的全身和局部灌注无明显变化。一项多中心试验比较了血管升压药滴定MAP65-70mm Hg与80-85 mm Hg对脓毒性休克患者的病死率的影响。虽然没有报道对病死率的差异(28或90天),但更高的目标(80-85 mmHg)与更多的心律失常有关。在有慢性高血压病史的患者中,更高的目标MAP(80-85mmHg)与减少肾替代治疗有关。75岁或以上的患者可能受益于较低的目标(MAP60-65 vs 75-80 mmHg)。这些结果表明,虽然65 mmHg可能是大多数患者的一个很好的起始目标,但临床医生可能需要根据患者的具体病史和表现个体化目标。
正性肌力药物逐步增量时应同时测量CO和组织灌注。使用正性肌力药物达到超生理心输出量不会改善结局,应该避免。临床医生应该用全身和器官灌注的其他系列标记物(如乳酸,混合或中心静脉血氧饱和度,尿量,皮肤灌注,肾功能和肝功能,精神状态和其他血液动力学变量)补充血液动力学目标。已显示乳酸升高与各种类型休克中病死率增加相关。尽管乳酸增加不仅仅因为组织灌注不足,但它可以作为血流动力学支持充分性的标志。
监测和撤除应始终针对药物使用的效果而不是基于固定剂量来管理血管活性药物(但对于某些药物,例如血管加压素或血管紧张素可考虑最大剂量)。使用血管活性药物时应使用动脉血压监测来获得精确的血压水平。由于正性肌力药和血管升压药会影响心脏功能和组织灌注,所以主要使用超声心动图评估和定期检测血乳酸和混合静脉或中心静脉氧饱和度来监测CO。然而,有些患者人群可能会受益于肺动脉导管或脉搏波分析,无论是否进行校准。
血管活性药物减量及撤除与启动血管活性药物的适应症一样重要。因为高估了再次加重的风险,医生和护士可能会维持比所需更高的血压,或继续使用超治疗剂量的正性肌力药。我们建议一旦血流动力学稳定就应该立即逐渐撤除血管活性药物。计算机辅助撤药可以减少不必要的血管活性药物使用。
加压素通常是在撤除去甲肾上腺素后再行撤除,如在VASST和 VANISH实验进行的那样,因为首先撤回加压素与更多的血流动力学不稳定有关。
严重不良事件心律失常是血管活性药物最常见的并发症,范围从2%到25%不等, 去甲肾上腺素2-15%,肾上腺素约15%,多巴胺约25%,加压素约1-2%,合成人血管紧张素II约6%,多巴酚丁胺约25%,左西孟旦约6%(表2)。去甲肾上腺素和加压素的心律失常风险可能低于多巴胺、肾上腺素、多巴酚丁胺或左西孟旦。在一项跨国前瞻性队列研究中,使用儿茶酚胺类药物治疗是ICU患者危及生命的心律失常的主要触发因素,与患者住院病死率和神经系统后遗症独立相关。当儿茶酚胺类药物把MAP滴定至80-85mmHg时,心律失常的发生率可能更高。
在研究儿茶酚胺、血管加压素、血管紧张素II或左西孟旦的试验(和组间)中,1-4%的患者中发生了急性冠状动脉事件。卒中、肢体缺血和肠缺血的发病率分别为0.3-1.5,2和0.6-4%。儿茶酚胺类治疗脓毒性休克的患者中报告中枢神经系统出血大约为1%。这些严重的脑血管并发症更容易发生在血管活性药物输注速度快速变化和凝血功能障碍的患者中。
最近对文献进行了系统回顾,儿茶酚胺类药物输注引起的Takotsubo心肌病占所有药物引起的病例中的三分之一。β2肾上腺素能受体激动剂可加重乳酸酸中毒和ICU获得性高血糖。
表2与血管活性药物有关的主要严重不良反应
| 药物 | 心律失常 | 血管 | 代谢 | | 室上性 | 室性 | 心肌缺血 | 卒中 | 肢体 | 其它组织/器官 | | | 多巴胺 | 房颤
多源性房速; 心脏传导异常 | 室速/
室颤 | + | + | + | + | 尚未描述 | | 多巴酚丁胺 | 房颤
多源性房速; | 室速/
室颤 | + | 尚未描述 | 尚未描述 | 尚未描述 | 低钾血症 | | 肾上腺素 | 房颤
多源性房速; | 室速/
室颤 | +++ | + | + | + | 乳酸性酸中毒;
高血糖;
低血糖;
胰岛素抵抗;
低钾血症 | | 去甲肾上腺素 | 房颤
多源性房速;
心动过缓 | 室速/
室颤 | ++ | + | + | + | 尚未描述 | | 加压素 | 房颤
心动过缓 | 室速/
室颤 | ++ | + | + | + | 低钠血症 | | 血管紧张素II | ± | 室速/
室颤 | 尚未描述 | 尚未描述 | + | 尚未描述 | 尚未描述 | | 左西孟旦 | 房颤
多源性房速;交界性心动过速 | 室速/
室颤 | 尚未描述 | 尚未描述 | 尚未描述 | 尚未描述 | 代谢性碱中毒;
低钾血症 | | 艾司洛尔/ 兰地洛尔 | 心动过缓;
传导异常;
窦性停搏;
心脏停搏 | | + | 尚未描述 | + | 尚未描述 | 高钾血症; 代谢性酸中毒 |
原文链接

(责任编辑:admin) |




